Metodología de la investigación:
una garantía para el progreso en el conocimiento de la infección
F. Carballo Álvarez
Unidad de Investigación, Hospital Universitario de Guadalajara,
Guadalajara. Departamento de Medicina, Universidad de Alcalá.
A MODO DE INTRODUCCIIN:
UN EJEMPLO HISTIRICO
Y UNA HISTIRICA CONTRIBUCIIN
La Biblia (1) nos ofrece un remoto
ejemplo de muestreo y criterios de inclusión:
"El rey ordenó a Aspenaz,
jefe de personal de palacio, que escogiera entre los israelitas de
estirpe real o de familias nobles a jóvenes sin ningún
defecto físico, de buen parecer, bien instruidos, cultos, inteligentes
y aptos para servir en el palacio real, y que les enseñara
la lengua y la literatura de los caldeos."
Entre los seleccionados figuraba Daniel,
quien propuso a su cuidador el siguiente diseño de ensayo clínico
(2):
" Por favor, haz con nosotros
una prueba durante diez días: que nos den legumbres para comer
y agua para beber. Después compara nuestro aspecto con el de
los jóvenes que comen manjares de los que se sirven al rey,
y trátanos según el resultado."
El ensayo tuvo el resultado esperado
por Daniel (3):
"Al cabo de diez días tenían
mejor y más sano aspecto que todos los jóvenes alimentados
con los manjares que se servían al rey. Así que el inspector
les retiró su ración de comida y de vino y les daba
sólo legumbres."
Es evidente que la razón para
realizar el ensayo fue el deseo de Daniel y sus compañeros
de no comer lo mismo que los caldeos del entorno real, al parecer
aficionados al vino y los manjares. Para conseguirlo necesitó
demostrar la superior eficacia de la dieta israelita frente a la caldea.
Los autores nada dicen sobre si fue evaluada la calidad de vida...
Murray W. Enkin (4), ilustre epidemiólogo
clínico, menciona este episodio bíblico, que sitúa
hacia el 600 a. de C., como el primer ensayo clínico documentado.
Su sagacidad le permite identificar algunos importantes sesgos atribuibles
a este "estudio". Entre ellos cita uno muy evidente, que es el de
selección, y otro que es también importante, dado que
los "investigadores" no garantizaron el enmascaramiento. Además
critica la más que probable existencia de confusión
por intervención divina.
Si Daniel hubiera tenido a Enkin como
revisor es muy probable que el ensayo no hubiera sido publicado. Lo
que sí está claro es que el resultado de esta primitiva
investigación comparativa, aun sesgado, condujo a la toma de
una decisión, acotando en cierta medida la incertidumbre previa.
Unos 2400 años después
de lo acontecido con Daniel, concretamente en 1795, Pierre-Simon de
Laplace publica su "Ensayo filosófico sobre las probabilidades".
En esta obra subyacen los fundamentos que otorgan al ensayo clínico
su supremacía entre todos los estudios que pretenden mejorar
el conocimiento sobre el resultado de las intervenciones. Laplace,
en el epígrafe "del cálculo de probabilidades, aplicado
a la investigación de los fenómenos y de sus causas",
dice textualmente (5):
"La mayoría de las veces,
los fenómenos de la naturaleza están rodeados de tantas
circunstancias extrañas, mezclados con la influencia de tan
gran número de causas perturbadoras, que resulta muy difícil,
cuando son muy pequeños, detectarlos. La única forma
en que se puede lograr es multiplicando las observaciones a fin de
que, al llegar a destruirse los efectos extraños, los resultados
medios evidencien tales fenómenos. De lo que antecede se deduce
que esto no tiene lugar de forma rigurosa más que en el caso
de que el número de observaciones sea infinito; en todos los
demás casos, los resultados medios indican los fenómenos
con una probabilidad tanto más elevada cuanto mayor sea el
número de las observaciones y cuyo valor es importante determinar."
Y algo más adelante, en el mismo
epígrafe, habla en concreto de los tratamientos médicos:
"El cálculo de probabilidades
puede servir para apreciar las ventajas y los inconvenientes de los
métodos empleados en las ciencias conjeturales. Así,
para determinar cuál es el mejor de los tratamientos empleados
en la cura de una enfermedad, basta con experimentar cada uno de ellos
sobre un mismo número de enfermos, convirtiendo en absolutamente
análogas todas las circunstancias. La superioridad del tratamiento
más ventajoso se irá manifestando con mayor claridad
a medida que este número aumente, permitiéndonos el
cálculo conocer la probabilidad correspondiente a su ventaja."
Es decir, Laplace, entre otros muchos
conceptos valiosos, introduce la idea de que es posible calcular la
ventaja de un tratamiento siempre que garanticemos una buena precisión
gracias a un suficiente tamaño muestral, y una adecuada comparabilidad
entre grupos sólo obtenible eliminando toda circunstancia diferencial
entre ellos, excepto la directa atribuible al propio tratamiento.
Este tipo de construcción científica,
basada en la comparación y la disminución de la incertidumbre
mediante el cálculo de la probabilidad ligada a eventos, se
complementa desde la perspectiva del progreso del conocimiento con
el denominado método científico, cuya esencia es la
refutación de hipótesis, construidas como verdades aceptadas
de forma provisional. El rechazo de la verdad preexistente, o refutación,
permite aceptar una nueva verdad provisional, que a su vez podrá
ser refutada en el futuro. La evolución de este modelo obliga
a realizar cualquier tipo de investigación acorde con una larga
lista de requisitos (Tabla 1). Los ensayos clínicos presentan
algunas peculiaridades en cada uno de los puntos señalados
en la Tabla 1, como se irá viendo en esta revisión.
La investigación en un campo concreto aporta otro tipo de peculiaridades
que tienen que ver sobre todo con el contenido más que con
el continente de la investigación. Las peculiaridades de la
investigación con ensayos clínicos en las enfermedades
infecciosas se refieren al tipo de pregunta, de población,
de variables de interés y de instrumentos de medida, más
que a la metodología en sí.

Revisaremos primero los aspectos más
destacables de la metodología general de toda investigación,
y de la realizada mediante ensayos clínicos en particular,
y tras ello, con los mismos criterios generales, se planteará
el ensayo clínico desde la perspectiva del usuario de la ciencia,
es decir, se discutirán los elementos de análisis crítico,
síntesis de la información y uso de ésta para
la toma de decisiones.
ASPECTOS METODOLIGICOS GENERALES
El paciente es quien mejor puede transmitir
al médico sus necesidades. El médico que asiste pacientes,
mediante la observación clínica, es quien mejor identifica
los problemas, o lagunas de conocimiento, que surgen al intentar atender
esas necesidades. Por ello, los personajes más legitimados
para plantear preguntas relevantes sobre problemas clínicos
son el paciente y su médico. Si el problema clínico
que subyace en la pregunta puede ser resuelto a la luz del conocimiento
disponible, la estrategia a aplicar es la de la búsqueda de
evidencia y su aplicación. Si no fuere así, o las evidencias
fueran inaplicables en el medio concreto en que se trabaja, el siguiente
paso natural de la actividad asistencial debe ser la formulación
de una pregunta de investigación (Fig. 1).
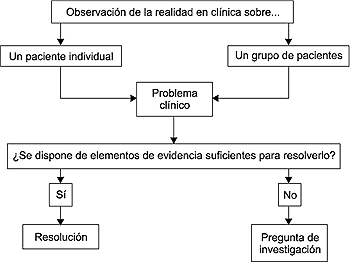
Figura 1. El arranque de toda
investigación clínica: de la observación a la
pregunta de investigación.
Para responder a las preguntas de investigación
con rigor es imprescindible, como se adelantó en la introducción,
apoyarse en el método científico (Fig. 2). Los dos pilares
de la investigación de calidad son relevancia de la pregunta
y, por supuesto, correcta metodología. Con una buena metodología
puede obtenerse un conocimiento ajustado sobre un asunto intrascendente,
lo que puede ser irrelevante pero no dañino; con una mala metodología
pueden obtenerse conclusiones falsas sobre un tema trascendente, hecho
que ya no es irrelevante sino claramente perjudicial para los pacientes.
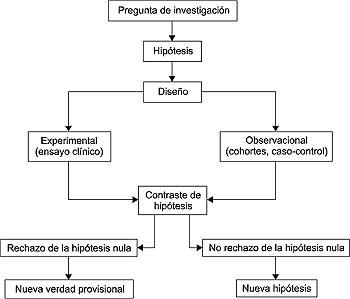
Figura 2. El método científico,
en esquema y aplicado a la investigación clínica.
Una de las dificultades más
corrientes a la hora de formular el problema origen de la pregunta
de investigación es establecer un enunciado manejable y que
pueda ser investigado. Con frecuencia los enunciados iniciales del
problema son demasiado extensos y vagos, motivando como consecuencia
una confusión en las posteriores actividades de la investigación.
Una vez identificado y formulado el
problema, el investigador debe reflexionar con detenimiento sobre
la pertinencia del estudio, es decir, sobre si está o no justificada
su realización. Para ello conviene buscar respuesta a las siguientes
preguntas: ¿Tiene interés el problema planteado? ¿Ha
sido ya respondido? ¿Es posible responderlo? ¿Es viable
para el investigador responderlo?
La revisión bibliográfica
es fundamental, no sólo al comienzo de la investigación
sino en todas sus etapas, ya que el conocimiento de los estudios previos
es útil tanto a la hora de planificar el estudio como en el
momento de interpretar los resultados. Para que los resultados de
una investigación sean útiles deben ampliar los conocimientos
y las teorías ya existentes y, de esta forma, constituirse
como guía para la actividad de investigación futura.
La revisión bibliográfica
tiene varias finalidades:
Permite conocer si el tema ha
sido planteado previamente y ayuda al investigador a enfocar la atención
en aspectos del problema que se conocen menos y a formular preguntas
de investigación más adecuadas y de mayor aportación
al cuerpo de conocimientos.
Permite valorar las hipótesis
o modelos explicativos subyacentes que determinan el problema a investigar.
Brinda la justificación
adecuada de la necesidad de la investigación.
Permite conocer cuáles
son los tipos de diseño y análisis empleados, así
como los resultados obtenidos.
La revisión bibliográfica
consistirá en la consideración y lectura crítica
de las publicaciones existentes, de las cuales se evaluará
la solidez científica, así como las limitaciones de
la información que ofrecen, lo que otorga un conocimiento sobre
el tema de investigación suficiente para el establecimiento
del marco teórico.
El investigador debe poseer sólidos
conocimientos sobre el tema objeto de su trabajo. No es concebible
abordar proyectos de investigación desde perspectivas conceptuales
pobremente desarrolladas. En consecuencia, tras la revisión
bibliográfica precisa, actualizada y crítica, se debe
abordar la construcción de los fundamentos que definen el marco
teórico sobre el que se sustentará la hipótesis
conceptual. En este apartado debería exponerse claramente el
modelo o la teoría que se pretende examinar, sea a través
de un experimento o de una nueva observación, especificando
cuál es el respaldo conceptual que sustenta al modelo.
El objetivo de la investigación
debe ser expuesto en términos generales, pero con absoluta
precisión. Define la esencia del proyecto de investigación.
No se deben exponer objetivos vagos o imprecisos. Es muy importante
tener en cuenta que un objetivo demasiado amplio es imposible de desarrollar
en un solo proyecto de investigación.
Cuando llega el momento de formular
las preguntas de investigación concretas deben plantearse aquellas
que se espera responder en relación con el objetivo propuesto.
No es conveniente formular más de dos o tres preguntas. Si
se formulan más es probable que el objetivo sea poco preciso.
Resulta útil numerar las preguntas según su importancia.
Toda pregunta de investigación
puede, y debe, expresarse también como una hipótesis.
En investigación clínica, tras la pregunta de investigación
el método científico exige la formulación de
una hipótesis, que en su variante nula se somete a contraste
dentro de un protocolo de investigación con un diseño
bien establecido (Fig. 2). Como se ha adelantado, si la hipótesis
nula puede ser rechazada es posible admitir que la hipótesis
planteada por el investigador es una verdad provisional útil
para la respuesta de la pregunta y por tanto para la solución
del problema que la originó. Si no fuere así, la hipótesis
nula debe ser mantenida, y si el investigador quiere contestar la
pregunta original debe formular una nueva hipótesis.
Las hipótesis pueden formularse
en el siguiente orden:
Hipótesis conceptual:
se corresponde con el objetivo propuesto.
Hipótesis operativa:
expresa la hipótesis conceptual en términos operativos
y medibles. Sirve de enlace con las hipótesis estadísticas.
Se relaciona con los objetivos concretos.
Hipótesis estadística:
se expresa en términos de hipótesis nula e hipótesis
alternativa.
La hipótesis alternativa coincide
con la operativa. La hipótesis nula es aquella que rechazaríamos
en caso de que nuestra hipótesis operativa pueda ser aceptada.
En estadística lo que se contrasta es la hipótesis nula.
Si puede ser rechazada se acepta la hipótesis alternativa,
dando por válida (es decir, como estadísticamente significativa)
nuestra respuesta a la pregunta formulada en los términos operativos
establecidos (hipótesis operativa). Si la hipótesis
nula no puede ser rechazada no podemos descartar que sea verdad, y
es por tanto imposible aceptar nuestra respuesta como válida
sin arriesgarnos a una equivocación (obtenemos por tanto un
resultado estadísticamente no significativo). El margen de
error (probabilidad de equivocarnos) que toleramos a la hora de rechazar
la hipótesis nula se denomina error estadístico alfa
o tipo I. Habitualmente se acepta que el error alfa no debe ser superior
al 5% (o sea, la probabilidad de equivocarnos al decir que la hipótesis
nula es falsa no debe ser superior a 0,05: ¡la famosa p!). El
error que podemos cometer al aceptar la hipótesis nula, porque
no la podemos rechazar al superar un error alfa del 5%, si es que
en realidad la hipótesis alternativa es verdadera, se denomina
error beta o tipo II. El error beta máximo deseable es de un
10% (0,1 en términos de probabilidad), o todo lo más
de un 20% (0,2 en probabilidad). Al complementario del error beta
se le denomina potencia del estudio (potencia = 1-beta). Por tanto,
la potencia ideal de un estudio debe ser del 90% o más, y nunca
debería bajar del 80%. El aumento del tamaño muestral
aumenta la potencia, y de ahí la importancia de calcular previamente
en cualquier estudio el tamaño muestral adecuado para nuestra
hipótesis operativa. En estadística podemos afirmar
que la hipótesis alternativa es cierta si podemos rechazar
la hipótesis nula. Sin embargo, no podemos afirmar nunca la
hipótesis nula, sino simplemente dudar de que sea falsa, viéndonos
así abocados a no rechazarla, y por tanto no afirmando la alternativa.
Para garantizar razonablemente que a pesar de todo la alternativa
no es verdad debemos estar seguros de la potencia de nuestro estudio.
Tras formular las hipótesis
es conveniente exponer las consecuencias que se derivarían
de su aceptación o refutación o, en su caso, de las
respuestas a las preguntas de investigación. En este sentido
se puede realizar una aproximación a la aplicabilidad y relevancia
de los resultados que se esperan obtener con el estudio.
Cuando ya se dispone de una adecuada
construcción de las hipótesis puede comenzarse con la
estrategia del estudio propiamente dicho. Consiste en desarrollar
todos los aspectos que se refieren al diseño e instrumentación
del trabajo. Es la parte metodológica en la cual se detallan
todos los pasos, medidas, intervenciones y análisis que permitirán
desarrollar el protocolo de investigación según los
objetivos planteados. Al menos es necesario detallar los siguientes
apartados:
Ámbito del estudio:
en él se expone el marco temporal y geográfico en que
se realizará el estudio, definiendo además los sujetos
del estudio, población objetivo o diana, la población
de muestreo, la unidad de muestreo y la propia muestra. Debe especificarse
la técnica de muestreo que se piensa aplicar. Es importante
también definir los criterios de inclusión y exclusión
de los participantes.
Diseño del estudio:
conviene definir el tipo de diseño elegido para llevar a cabo
el proyecto. Esta elección dependerá de la pregunta
de investigación formulada y de las posibilidades reales para
responderla. La elección del modelo debe haber sido respaldada
conceptualmente al definir el marco teórico. Es muy importante
no mezclar distintos tipos de diseño en el mismo estudio.
Variables: las variables
son los aspectos que se desea estudiar y que se caracterizan por tomar
diferentes valores en la población de estudio. Las variables
se seleccionan según su relevancia para los objetivos del estudio
y deberán definirse con claridad. Son variables dependientes
aquellas directamente relacionadas con el objetivo, y por tanto definen
los resultados. Estas variables deben ser seleccionadas muy cuidadosamente,
eligiendo sólo las auténticamente representativas y
necesarias. El ideal, no siempre posible, sería disponer de
una sola variable dependiente que aportase toda la información.
Son variables independientes aquellas de las que se conoce o sospecha
que pueden relacionarse con las características o variables
que se quieren estudiar (variables dependientes). Entre ellas se seleccionarán
también sólo las más importantes, bien por su
relación con la variable dependiente o por su efecto de posible
confusión o de modificación del efecto. Una vez definidas
conceptualmente las variables de estudio se procederá a su
definición operativa, especificando claramente los procedimientos
de medida. Todas las variables deben haber sido definidas de tal modo
que no quepa posibilidades de error a la hora de su clasificación.
Instrumentos de medida:
deben ser descritos, justificada su elección, validados y,
si procede, verificada la concordancia entre instrumentos u observadores.
Errores tipo I y II tolerados,
así como potencia del estudio y tamaño de la muestra
en función de los términos establecidos en la hipótesis
operativa.
Obtención de los
datos, elaboración de la base de datos y control de calidad
de éstos. Se expondrá el protocolo y el sistema de recogida
de datos elegido. Si procede, se especificarán las características
y el entrenamiento de las personas encargadas de esta recogida. Debe
mencionarse el soporte informático seleccionado. Son de especial
interés los sistemas aplicados para garantizar la calidad de
los datos.
Análisis de los
datos: técnicas estadísticas a aplicar para los contrastes
de hipótesis. Deben detallarse todas las técnicas que
se piensa aplicar para el análisis de los datos. La estrategia
de análisis nunca puede establecerse a posteriori.
Cronograma del estudio:
se establecerá un calendario, en términos reales, de
las actividades a realizar, especificando las personas o grupos encargados
de cada tarea.
Presupuesto: la investigación
implica un gasto que debe ser estrictamente evaluado. Por ello, un
proyecto es inaceptable si carece de una previsión realista
de coste. Deben especificarse todos los costes, incluyendo los de
personal y utilización de instalaciones.
Informe sobre los aspectos
éticos y legales: cualquier estudio que suponga intervención
o utilización de datos personales debe ser evaluado desde la
perspectiva de la bioética y la legislación.
TIPOS DE ESTUDIO
EN INVESTIGACIIN CLENICA:
EL ENSAYO CLENICO COMO MÉTODO
EXPERIMENTAL
Entre los diferentes tipos de diseños
posibles en investigación clínica (Tabla 2), el investigador
debe seleccionar aquél que mejor se ajuste al tipo de pregunta
formulada. Una primera clasificación de los tipos de estudios
deriva de la elección del método de verificación
de la hipótesis planteada: experimentación o nueva observación.

La experimentación es, sin duda,
la forma ideal de verificar una hipótesis. En los estudios
experimentales el investigador manipula el factor de interés,
determinando qué personas han de estar expuestas al factor
y cuáles no. Esto es lo que acontece en el ensayo clínico.
La asignación al grupo experimental o al grupo control se hace
aleatoriamente. El objetivo es controlar todas las condiciones del
estudio para, de este modo, poder atribuir únicamente al factor
en estudio los efectos observados.
No obstante, el hecho de que el ser
humano sea el objeto de estudio representa un claro obstáculo
desde el punto de vista ético para aplicar el método
experimental a la investigación clínica. De esta forma,
los estudios experimentales quedan reservados para aquellos casos
en que el factor de estudio represente una medida claramente orientada
a promover la salud, prevenir la enfermedad o mejorar su pronóstico.
Aún más, los ensayos clínicos son obligatorios
en el caso de intervenciones médicas, las cuales deben ser
evaluadas mediante experimentos antes de que se autorice su uso en
miles de personas.
En el ensayo clínico, si se
parte de una hipótesis nula honesta, el investigador se sitúa
en una posición de incertidumbre tal que no puede afirmar si
el nuevo procedimiento en investigación es realmente mejor
que lo que hasta ese momento viene haciéndose. La única
posibilidad de despejar esa incertidumbre es investigar comparando
procedimientos con asignación aleatoria.
Frente a los estudios experimentales
están los estudios observacionales, que se basan en la observación
como método de verificación de la hipótesis de
partida. En estos estudios el investigador no interviene, manipula
ni ejerce ningún control sobre las variables. Dentro de los
estudios observacionales, la elección del tipo específico
de diseño va a depender básicamente de dos cuestiones:
el objetivo del estudio y las características de la enfermedad
estudiada. Si el objetivo es describir la frecuencia de enfermedad,
el tipo de diseño va a depender directamente de las características
de la enfermedad en estudio:
Si la enfermedad es rara
o tiene un periodo de latencia largo, el diseño más
adecuado será un estudio de corte transversal. Los estudios
transversales nos dan idea del estado de salud de la población
con respecto a la enfermedad en estudio, al describir una situación
existente en un momento dado. Son, por lo tanto, muy útiles
para la organización y planificación sanitaria, así
como para la formulación de hipótesis. Estos estudios,
sin embargo, no son útiles para establecer la relación
entre una determinada variable y el desarrollo de la enfermedad, ya
que al describir una situación en un determinado momento no
se puede determinar si el factor de riesgo precede a la enfermedad
o es consecuencia de ella, es decir, no existe una secuencia temporal
de los hechos. La medida de frecuencia de enfermedad utilizada es
la prevalencia (proporción de enfermos en la población
de estudio en un momento dado), por lo que estos estudios también
se denominan "de prevalencia".
Si la enfermedad es frecuente
o tiene un periodo de latencia corto, el diseño más
adecuado será un estudio longitudinal. En él mediremos
la incidencia de enfermedad o proporción de individuos sanos
que contraen la enfermedad en un periodo de tiempo.
Puesto que el objetivo de estos estudios
observacionales es únicamente describir una situación
existente o un cambio en la situación, también se denominan
estudios "descriptivos".
Si el objetivo del estudio es analizar
la relación existente entre un determinado factor de exposición
y una enfermedad, entonces el diseño puede ser básicamente
de dos tipos:
Si los pacientes se seleccionan
en función del factor de exposición y durante su seguimiento
se estudia la aparición de la enfermedad, el tipo de diseño
es un estudio de cohortes. Una cohorte es un grupo definido de personas
con alguna característica común en el momento de ser
agrupadas. En este caso la cohorte está formada por un grupo
de individuos libres de la enfermedad de estudio a los cuales el investigador
clasifica en expuestos (al factor de riesgo) y no expuestos. Las preguntas
a contestar por un estudio de cohortes son las siguientes: ¿Es
más frecuente la aparición de la enfermedad en las personas
expuestas que en las no expuestas? ¿Cuánto mayor es esa
frecuencia? Para contestar a tales preguntas ambos grupos son seguidos
durante un periodo de tiempo, pudiendo observar al final la incidencia
de enfermedad, que indica la probabilidad o riesgo medio para desarrollar
la enfermedad en el periodo de tiempo considerado, en ambos grupos.
Además, podemos cuantificar la fuerza de la asociación
entre factor de exposición y enfermedad mediante la comparación
de las incidencias obtenidas para cada grupo (razón de riesgos
o riesgo relativo). Frente al estudio de cohortes de carácter
prospectivo (el inicio del estudio es anterior a los hechos estudiados)
existen también los estudios de cohortes retrospectivos, donde
el diseño del estudio es posterior a los hechos estudiados.
La clasificación de los participantes según la presencia
o ausencia de exposición al factor de riesgo se ha realizado
en el pasado. La posibilidad de errores es mayor que en los estudios
de cohortes prospectivos. En el diseño de cohortes, el factor
de riesgo se identifica antes de que se diagnostique la enfermedad,
por lo que la secuencia temporal es clara. Permiten además
el estudio de varias enfermedades relacionadas con un mismo factor
de riesgo, siendo muy útiles cuando la exposición de
interés es infrecuente en la población general, ya que
la cohorte puede ser reclutada en aquellos ambientes en que la exposición
sea máxima. Entre los inconvenientes más importantes
destaca el hecho de que son estudios muy caros y de larga duración,
no siendo útiles para el estudio de enfermedades raras o con
periodos de latencia largos, ya que en ambas situaciones serán
pocos los casos que irán apareciendo durante el tiempo de estudio,
por lo que serían necesarios enormes tamaños muestrales
y desmesurados seguimientos para demostrar diferencias significativas
en la exposición. Por último, si la pérdida de
sujetos durante el seguimiento es alta hay que tener mucho cuidado
a la hora de interpretar los resultados, ya que si la no participación
está relacionada con la exposición y con otros factores
de riesgo para la enfermedad, puede afectar a la validez del estudio.
Si los individuos se seleccionan
en función de la enfermedad y posteriormente medimos de forma
retrospectiva la exposición al factor de estudio, el tipo de
diseño es un estudio caso-control. Por lo tanto, en un estudio
caso-control se selecciona un grupo de individuos que padecen una
determinada enfermedad (casos) y otro grupo de individuos que no la
padecen (controles). Posteriormente se recoge para cada uno de los
individuos información sobre la exposición a un determinado
factor en estudio. Las preguntas a contestar por un estudio caso-control
son las siguientes: ¿Manifiestan con más frecuencia la
característica de exposición los casos que los controles?
¿Cuánto mayor es esa frecuencia? Dado que estos estudios
no miden prevalencia ni incidencia, para contestar las preguntas calcularemos
las odds (disparidades) de exposición (razón
de expuestos/no expuestos) para cada grupo (casos y controles). Además,
podemos cuantificar la fuerza de la asociación entre factor
de exposición y enfermedad mediante la comparación de
las odds obtenidos para cada grupo (odds ratio, cociente
de disparidades). En el diseño caso-control el factor de riesgo
se identifica después de que se diagnostique la enfermedad,
por lo que la secuencia temporal entre la exposición y la enfermedad
no resulta en ocasiones tan fácil de establecer como en los
estudios de cohortes. El hecho de que la enfermedad que queremos estudiar
sea poco frecuente o tenga un periodo de latencia largo es la principal
razón para escoger el diseño caso-control, permitiendo
medir la fuerza de la asociación entre causa y efecto sin necesidad
de observar todo el proceso en el tiempo desde que empieza la exposición
hasta que se desarrolla la enfermedad. De esta forma es posible disminuir
el coste y la duración del estudio. Permiten además
el estudio de varios factores relacionados con una misma enfermedad.
Entre los inconvenientes más importantes destaca el hecho de
que son estudios poco eficientes para evaluar una exposición
rara. Por último, este tipo de diseño está más
sujeto a sesgos (estimación equivocada del efecto) que los
estudios de cohortes (sesgos de selección y de información,
especialmente).
Es obvio el aumento de fiabilidad que
el diseño tipo ensayo clínico con asignación
aleatoria ofrece sobre los estudios estrictamente observacionales.
También es obvio que el ensayo clínico sólo es
admisible si el enfermo está plenamente informado y consiente,
si se garantiza un correcto equilibrio entre posibles daños
y beneficios esperables, y si son realizados sólo en la situación
de incertidumbre que antes se ha comentado. Para cerrar este punto
es interesante volver a llamar la atención sobre el papel que
el ensayo clínico tiene en la validación de procedimientos.
Por esta función, el ensayo clínico no sólo es
una experimentación moralmente aceptable, sino éticamente
necesaria para garantizar la calidad de la asistencia, al menos en
términos de aplicación de procedimientos evaluados como
eficaces y seguros.
Pero aún hay otras formas de
expresar los resultados de un ensayo, y algunas de ellas son especialmente
interesantes para juzgar en clínica la importancia de los resultados
de un ensayo clínico, o llegado el caso de un conjunto de ellos
(Fig. 3). Está en primer lugar la denominada "reducción
absoluta del riesgo" (RAR). La RAR expresa la diferencia entre la
proporción de episodios resultado observados en el grupo control
y los observados en el grupo experimental. Esta diferencia de riesgo
absoluta es fácil de asimilar clínicamente, puesto que
nos indica en términos absolutos la diferencia atribuible al
tratamiento. Un ejemplo de esto sería un ensayo en el cual
la proporción de sujetos que han erradicado un determinado
microorganismo entre los pacientes tratados con un nuevo fármaco
en estudio (grupo experimental) fuera de 0,93 (93%), mientras que
la proporción entre los que recibieran un antibiótico
ya aceptado como eficaz fuera de 0,84 (84%). En este caso, la RAR
es de 0,09 (9%).

Figura 3. Concepto y forma de
calcular la reducción absoluta de riesgo (RAR), la reducción
relativa de riesgo (RRR) y el número que se necesita tratar
(NNT).
Otra posibilidad es calcular la "reducción
relativa del riesgo" (RRR). La RRR es igual a la RAR dividida por
la proporción de episodios observados en el grupo control.
En el caso del ejemplo, RRR = 0,09/0,84 = 0,107 (10,7%). Veamos ahora
un segundo ejemplo. Se trata de un ensayo en que se prueba un antibiótico
en la profilaxis de la infección de la necrosis pancreática,
en el cual el grupo control recibe un placebo. La variable resultado
considerada es la muerte. Imaginemos que al final del estudio la proporción
de fallecidos en el grupo control es 0,16 (16%) frente a 0,07 (7%)
en el grupo experimental. La RAR de este segundo ejemplo es la misma
del primero: 0,09 (9%); sin embargo, la RRR es marcadamente diferente,
ya que ahora RRR = 0,09/0,16 = 0,562 (56,2%).
Una conclusión inmediata es
que la RRR puede ser engañosa al juzgar el impacto clínico
de un ensayo, puesto que su interpretación depende directamente
de la frecuencia de la variable resultado elegida: alta si hablamos
de erradicación, menor si hablamos de muerte. Por ello es preferible
acudir a un concepto relativamente nuevo, que es el denominado "número
que se necesita tratar" (NNT). El NNT se relaciona directamente con
el valor de RAR, ya que NNT = 1/RAR. Si volvemos a los ejemplos, en
ambos casos el NNT es igual a 1/0,09, es decir 11,1. Ahora la interpretación
es que sería necesario tratar a once pacientes para conseguir
una erradicación más con el nuevo tratamiento, en el
caso del primer ejemplo, o exactamente el mismo número de pacientes
si queremos evitar una muerte con el antibiótico del segundo
ejemplo.
Cuando se quiere obtener información
sobre la eficacia y la seguridad de los procedimientos diagnósticos,
el ensayo clínico vuelve a ser el diseño más
potente. Un ensayo clínico sobre un procedimiento diagnóstico
es extraordinariamente útil para decidir su capacidad para
modificar el escenario asistencial en que se aplica. Sin embargo,
la habitual aproximación a la evaluación de las pruebas
diagnósticas es observacional y sigue criterios semejantes
a los descritos para los estudios tipo caso-control. En este caso,
las medidas más frecuentes son la proporción de positivos
para la prueba entre el total de enfermos (sensibilidad o coeficiente
de verdaderos positivos), que indica la probabilidad de dar positivo
en la prueba dado que se está enfermo, y la especificidad o
coeficiente de verdaderos negativos, que es la probabilidad de que
un sujeto dé negativo en la prueba dado que no está
enfermo. Los complementarios de la sensibilidad y la especificidad,
respectivamente, son los coeficientes de falsos negativos y de falsos
positivos. Si se conoce la prevalencia de la enfermedad es posible,
gracias al teorema de Bayes, calcular la probabilidad de estar enfermo
con un test positivo (probabilidad posprueba positiva), y la probabilidad
de no enfermar dado que el test ha sido negativo. Estos valores, cuando
la prevalencia está correctamente representada dentro del propio
estudio, coinciden con los conceptos de valor predictivo positivo
y valor predictivo negativo. El valor predictivo negativo es, a su
vez, el complementario de la probabilidad de estar enfermo puesto
que se tiene un resultado negativo en la prueba (probabilidad posprueba
negativa). Al cociente sensibilidad/ (1especificidad) se le
conoce como cociente de probabilidad de un resultado positivo (CP+),
siendo el cociente de probabilidad de un resultado negativo (CP)
igual a (1sensibilidad)/especificidad. Ya se ha aclarado que
la prevalencia indica la probabilidad de que un sujeto esté
enfermo en la población de la que se parte, siendo por tanto
igual a la probabilidad de estar enfermo antes de aplicar la prueba
(probabilidad preprueba). En consecuencia, la odds preprueba
es igual a prevalencia/(1prevalencia). Conociendo la prevalencia
y los cocientes de probabilidades es posible calcular las probabilidades
posprueba, ya que la odds posprueba es igual a la odds
preprueba por el cociente de probabilidad, y la probabilidad posprueba
igual a odds posprueba/(odds posprueba +1). Sabiendo
esto, cuando un clínico se aproxima a los resultados de una
correcta investigación sobre diagnóstico, en la cual
puede identificar claramente la población sobre la que se ha
realizado el estudio, y siempre en el caso de que ese mismo tipo de
población sea aquella sobre la que él debe aplicar la
prueba en cuestión, no necesita que la probabilidad preprueba
local sea la misma que en el estudio original para saber cuál
será el impacto de la prueba en su medio. A partir de una sensibilidad
y una especificidad no sesgadas puede calcular perfectamente las probabilidades
posprueba a partir de su propia probabilidad preprueba, o prevalencia
local.
Además de las preguntas sobre
diagnóstico y sobre tratamiento también es importante
considerar las que se refieren al pronóstico. En este caso
son diversas las posibilidades.
Una primera variante es abordar el
pronóstico estimando el impacto beneficioso de la prevención
secundaria. Consiste en la identificación precoz mediante cribado
de los casos más favorables al tratamiento. En esta situación,
las medidas de interés proceden tanto de la metodología
de la evaluación de pruebas diagnósticas como de la
del ensayo clínico. Así, es factible calcular la sensibilidad
y especificidad del método de cribado, junto con sus cocientes
de probabilidad y probabilidades preprueba y posprueba. También
es perfectamente factible realizar un ensayo clínico con asignación
aleatoria, estimando a su fin los correspondientes RR y NNT, que en
este caso sería el número de sujetos a los que sería
necesario aplicar la prueba de cribado para conseguir una observación
favorable más respecto del grupo control.
Una segunda forma clásica de
abordar el pronóstico es aplicar un diseño de cohortes
en el cual la variable resultado sea algún tipo de desenlace
de la enfermedad. En este tipo de estudios, además de poder
explicar el desenlace por una o más de las variables consideradas,
el análisis multivariante ofrece la posibilidad de establecer
funciones matemáticas predictivas.
Una tercera vía de estudio en
cuanto al pronóstico, también muy frecuente sobre todo
en cáncer y trasplantes, es considerar el tiempo de supervivencia
como variable de interés. También en este caso es posible
explicar o predecir la supervivencia a partir de los modelos más
habitualmente empleados.
LA INVESTIGACIIN DESDE
LA PERSPECTIVA DE SUS USUARIOS
Un importante problema de la investigación
clínica es conseguir rellenar plenamente el espacio que media
entre la producción de resultados de investigación útiles
para la práctica clínica y una auténtica modificación
de ésta basada en esos resultados. Y este problema es complejo,
de no fácil solución y con varias caras:
Los resultados de investigación
se producen uno a uno. Es excepcional que un procedimiento pueda ser
razonablemente validado a partir de un solo estudio. De hecho, no
es infrecuente que los resultados de los estudios difieran entre sí,
e incluso sean opuestos. Las razones cabe buscarlas en la variabilidad
y en la existencia de los errores aleatorios y sistemáticos.
Por ello, en gran número de ocasiones será necesaria
una aproximación sintética a las evidencias disponibles.
Un buen estudio, capaz
de aportar información valiosa, no tiene por qué ser
fácilmente accesible. Buen ejemplo de esto es la denominada
"literatura gris". Es frecuente que estudios locales, con resultados
negativos, comunicados a congresos, de autores noveles o no introducidos
en los círculos habituales de producción científica,
o de realización reciente, no estén disponibles como
originales en revistas indexadas de amplia circulación.
La calidad de los estudios
no está en absoluto garantizada. Una de las tareas más
arduas del clínico que busca información útil
para su práctica es decidir cuál de esa información
es válida, importante y aplicable en su paciente o en su medio.
Para la crítica de la información científica
el profesional debe contar con conocimientos en metodología
de la investigación clínica, en línea con lo
que se viene exponiendo, y entrenamiento en la apreciación
crítica de la literatura científica.
Generalmente es excesivo
el tiempo que media entre la producción de la evidencia y su
integración en la actividad clínica. Reducir este tiempo
depende de la rapidez de adquisición de la información,
pero también de la rapidez de su crítica y verificación
de su aplicabilidad.
El crisol de la denominada
"medicina basada en la evidencia" es su aplicabilidad. Y éste
es también su mayor reto. La única forma de verificar
si la medicina basada en la evidencia es realmente útil, en
términos de modificación favorable de la práctica
clínica, es esforzarse en su uso y, sobre todo, evaluar este
uso. Las palabras clave de la medicina basada en la evidencia son
acceso a la información científica, crítica y
síntesis de ésta, y aplicación del producto a
la práctica asistencial.
La accesibilidad a la información
científica se ha modificado drásticamente en los últimos
años. El problema actual, más que no poder acceder,
es cómo seleccionar la ingente información disponible.
No obstante, sigue siendo un problema el estar seguro de que entre
la masa de información disponible y accesible no falte precisamente
la que sería relevante para nuestro problema. Para solventar
esta doble dificultad de selección y exhaustividad, la mejor
forma de trabajar es manejar cada vez un mayor número de bases
de datos, pero con criterios muy eficientes de búsqueda. En
el presente se están realizando esfuerzos considerables en
el desarrollo de lenguajes de búsqueda comunes a las diferentes
bases, así como en la interconexión de éstas.
Otro gran avance son los motores de búsqueda, capaces de extraer
información simultánea, sin duplicaciones, desde diversas
bases. Respecto a la incorporación de la literatura gris, la
solución pasa por la introducción en las fuentes de
información de estos resultados mediante el esfuerzo de redes
de rastreo. Y, por supuesto, en este sentido es también crítica
la colaboración de los promotores de investigación,
sobre todo la industria farmacéutica, abriendo sus archivos
de resultados de investigación al conjunto de la comunidad
científica.
Para la crítica y síntesis
de la información, la medicina basada en la evidencia trabaja
básicamente en dos frentes. El primero es la definición
de estrategias de apreciación crítica de la literatura;
el segundo es la denominada síntesis de la evidencia.
La apreciación crítica
de la literatura se basa en un buen conocimiento de la metodología
de la investigación clínica, puesto que la validez de
los resultados dependerá de la calidad de la investigación
de donde parten. Para juzgar la importancia de esos resultados ya
se han detallado algunas de las medidas útiles, dentro de los
estudios sobre diagnóstico, tratamiento y pronóstico.
En los estudios sobre diagnóstico
la pregunta sobre la validez pasa por las siguientes consideraciones:
Debe ser identificable
y aceptable el estándar que permitió clasificar adecuadamente
los casos. Este estándar no debe verse influido por el resultado
de la prueba en estudio.
La comparación mejor
es aquella que se realiza de forma ciega e independiente.
Los pacientes seleccionados
para el estudio deben ser verdaderamente representativos del conjunto
de la enfermedad sobre la que se pretende aplicar la prueba, y no
sólo de un determinado estrato de ella.
La importancia de los estudios sobre
diagnóstico se juzga a partir de los resultados inherentes
a la prueba, como la sensibilidad y la especificidad, y también
por su capacidad para modificar la probabilidad de presentar la enfermedad.
Respecto a la posible aplicación
de un estudio diagnóstico en la asistencia de pacientes, la
reflexión fundamental es valorar si realmente su aplicación,
si es que ha superado las etapas previas de validez e importancia,
va a modificar la decisión clínica. Este detalle, que
parece obvio, no pocas veces es olvidado en aras de la aplicación
de las nuevas y fascinantes tecnologías, o simplemente en un
vano intento de afirmar nuestra propia inseguridad.
Las preguntas sobre la validez de los
ensayos clínicos son, básicamente:
¿Es realmente un ensayo
aleatorio con listas no manipulables de asignación?
¿Se ha realizado adecuadamente
la inclusión, valorando los casos consecutivamente?
¿Los resultados han
sido analizados teniendo en cuenta la asignación inicial de
los pacientes?
Además, debe valorarse la comparabilidad
de los grupos al inicio del tratamiento, el manejo semejante de ambos
grupos a lo largo del estudio, excepto en la intervención,
y el hecho de si el estudio fue o no ciego.
La forma de valorar la importancia
de los resultados de un estudio sobre tratamiento ya se ha expuesto
también al detallar los conceptos de reducción de riesgo
y número que es necesario tratar.
Respecto a la aplicabilidad de los
resultados en tratamiento, el clínico debería preguntarse
sobre las posibles diferencias entre sus pacientes y los del estudio
valorado, sobre si realmente sus enfermos se van a ver favorecidos
por ese tratamiento y, desde luego, sobre si el tratamiento en cuestión
cumple con las expectativas y preferencias del paciente.
En el caso del pronóstico, la
valoración de la validez pasa por la confirmación de
que la muestra fue lo suficientemente representativa y bien definida,
y sobre todo si los casos incluidos eran lo suficientemente precoces
como para valorar temporalmente la historia posterior de la enfermedad.
Es también muy importante estar seguro de que el seguimiento
ha sido suficientemente largo y de que la aplicación de los
criterios de valoración objetiva de resultados finales fue
ciega.
La importancia de un estudio pronóstico
guarda relación con la estimación de probabilidad de
que ocurra un determinado suceso en el tiempo, como también
se ha visto, y con la precisión de estas estimaciones. Finalmente,
la aplicabilidad del pronóstico vuelve a depender de la semejanza
o no de los pacientes propios con los del estudio, y de la adecuación
de los resultados con las necesidades de información de nuestro
paciente sobre la previsible evolución de su enfermedad.
Tras juzgar en cada uno de los estudios
disponibles si los resultados que exponen son válidos, importantes
y aplicables, subsiste el problema de la integración de la
información procedente de ellos. Una primera aproximación
a este problema es el metaanálisis, un procedimiento matemático
que permite obtener estimaciones de la medida global que se obtendría
a partir de un estudio que incorporara la totalidad de pacientes incluidos
en un conjunto de diferentes trabajos de investigación. Para
que el metaanálisis tenga sentido es exigible que los estudios
individuales de partida muestren un razonable grado de homogeneidad
y, como es lógico, que la medida del efecto sea la misma en
todos ellos. Una segunda característica de los metaanálisis
es la ponderación del peso de cada estudio. Ponderar los estudios
por su tamaño muestral es sencillo, pero ya no lo es tanto
la ponderación por calidad. Por ello, hoy se está evolucionando
rápidamente hacia una forma de síntesis de la evidencia
que incluye el metaanálisis, pero que es mucho más que
éste. Nos referimos a la denominada "revisión sistemática".
Un buen ejemplo de la pujanza de las
revisiones sistemáticas es el trabajo que viene realizando
la Colaboración Cochrane. Este grupo cooperativo trabaja en
la realización y difusión de revisiones sistemáticas
de gran calidad. En el segundo número del año 2001 de
la Cochrane Library, que es la publicación electrónica
del grupo, y sólo en el campo de las enfermedades infecciosas,
se recogen ya un total de 128 revisiones completas y 50 propuestas
en protocolo.
Correspondencia: Dr. Fernando
Carballo Ávarez, Unidad de Investigación, Hospital Universitario
de Guadalajara, c/Donantes de Sangre s/n, 19002 Guadalajara.
BIBLIOGRAFÍA
- Libro de Daniel. En: La Biblia cultural. PPC y
SM, Madrid 1998; 1: 3-4.
- Libro de Daniel. En:
La Biblia cultural. PPC y SM, Madrid 1998; 1: 12-13.
- Libro de Daniel. En:
La Biblia cultural. PPC y SM, Madrid 1998; 1: 15-16.
- Enkin, M.W. Foreword. En: Jadad, A. (Ed.). Randomised
controlled trials. BMJ Books, Londres 1998; vii-x.
- Laplace, P.S. Ensayo filosófico sobre las
probabilidades. Alianza Editorial, Madrid 1985; 82-97.
|